- מְחַבֵּר Jason Gerald gerald@how-what-advice.com.
- Public 2024-02-01 14:13.
- שונה לאחרונה 2025-01-23 12:18.
האם השארת פעם בקבוק מים בשמש החמה במשך כמה שעות ושמעת צליל "שורק" קל כשפתחת אותו? זה נובע מעקרון הנקרא לחץ אדים. בכימיה, לחץ אדי הוא הלחץ המופעל על ידי קירות מיכל סגור כאשר החומר הכימי בו מתאדה (הופך לגז). כדי למצוא את לחץ האדים בטמפרטורה נתונה, השתמש במשוואת קלאוסיוס-קלאפיירון: ln (P1/P2) = (ΔHקִיטוֹר/R) ((1/T2) - (1/T1)).
שלב
שיטה 1 מתוך 3: שימוש במשוואת קלאוסיוס-קלאפיירון
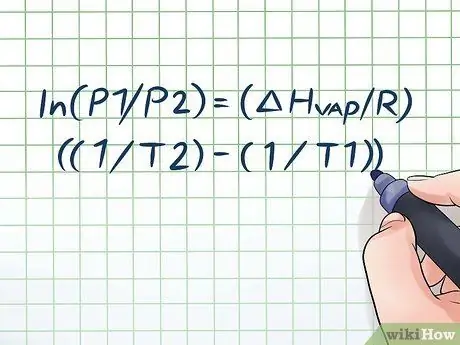
שלב 1. רשום את משוואת קלאוסיוס-קלאפיירון
הנוסחה המשמשת לחישוב לחץ האדים עם השינוי בלחץ האדים לאורך זמן נקראת משוואת קלאוסיוס -קלאפיירון (על שם הפיזיקאים רודולף קלאוסיוס ובנוט פול מייל קלאפירון.) זו בעצם הנוסחה שתצטרך לפתור את רוב סוגי הבעיות. שאלות הלחץ אדי נמצאות לעתים קרובות בשיעורי פיזיקה וכימיה. הנוסחה היא כך: ln (P1/P2) = (ΔHקִיטוֹר/R) ((1/T2) - (1/T1)). בנוסחה זו, המשתנים מייצגים:
-
חקִיטוֹר:
אנתלפיה של אידוי נוזל. בדרך כלל ניתן למצוא את האנתלפיה הזו בטבלה בחלקו האחורי של ספר הלימוד לכימיה.
-
R:
קבוע הגז האמיתי/אוניברסלי, או 8.314 J/(K × Mol).
-
ש 1:
הטמפרטורה שבה ידוע לחץ האדים (או הטמפרטורה ההתחלתית).
-
T2:
הטמפרטורה שבה לחץ האדים אינו ידוע/רצה להימצא (או הטמפרטורה הסופית).
-
P1 ו- P2:
לחץ אדים בטמפרטורות T1 ו- T2, בהתאמה.

שלב 2. הזן את המשתנים שאתה מכיר
משוואת קלאוסיוס-קלאפיירון נראית מסובכת מכיוון שיש לה הרבה משתנים שונים, אבל למעשה זה לא כל כך קשה אם יש לך את המידע הנכון. רוב הבעיות הבסיסיות בלחץ אדים יפרטו שני ערכי טמפרטורה וערך לחץ אחד או שני ערכי לחץ וערך טמפרטורה אחד - ברגע שתבין זאת, קל מאוד לפתור משוואה זו.
- לדוגמה, נגיד שאומרים לנו שיש לנו מיכל מלא בנוזל במהירות של 295 K שלחץ האדים שלו הוא 1 אטמוספרה (אטם). שאלתנו היא: מהו לחץ האדים ב 393 K? יש לנו שני ערכי טמפרטורה וערך לחץ אחד, כך שנוכל למצוא את ערכי הלחץ האחרים באמצעות משוואת קלאוסיוס-קלאפיירון. על ידי חיבור המשתנים שלנו, אנו מקבלים ln (1/P2) = (ΔHקִיטוֹר/R) ((1/393) - (1/295)).
- שים לב, עבור משוואת קלאוסיוס-קלאפיירון, עליך תמיד להשתמש בערך הטמפרטורה קלווין. אתה יכול להשתמש בכל ערך לחץ כל עוד הערכים עבור P1 ו- P2 זהים.

שלב 3. הזן את הקבועים שלך
למשוואת קלאוסיוס-קלאפיירון יש שני קבועים: R ו- Hקִיטוֹר. R תמיד שווה 8.314 J/(K × Mol). עם זאת, חקִיטוֹר (אנטלפיה של אידוי) תלוי בחומר שאת לחץ האדים שלו אתה מחפש. כפי שצוין לעיל, בדרך כלל אתה יכול למצוא את הערכים של Hקִיטוֹר לחומרים שונים בחלק האחורי של ספר לימוד כימיה או פיזיקה, או באינטרנט (כמו למשל כאן.)
-
בדוגמה שלנו, נניח שהנוזל שלנו הוא מים טהורים.
אם נסתכל בטבלה את הערכים של Hקִיטוֹר, אנו מוצאים כי חקִיטוֹר מים טהורים הם בערך 40.65 KJ/mol. מכיוון שערכנו H הוא בג'ול, ולא בקילו -ג'ול, אנו יכולים להמיר אותו 40,650 J/mol.
- מחברים את הקבועים שלנו, אנחנו מקבלים ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295)).
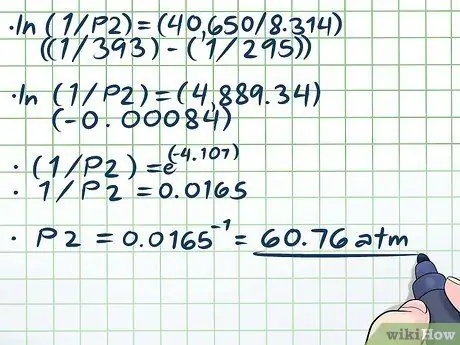
שלב 4. פתור את המשוואה
לאחר שכללת את כל המשתנים במשוואה פרט לזה שאתה מחפש, המשך לפתרון המשוואה על פי כללי האלגברה הרגילה.
-
החלק הקשה היחיד בפתרון המשוואה שלנו (ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295))) הוא פתרון היומן הטבעי (ln). כדי להסיר את היומן הטבעי, פשוט השתמש בשני צידי המשוואה כמעריכים עבור הקבוע המתמטי e. במילים אחרות, ln (x) = 2 → הln (x) = ה2 → x = ה2.
- עכשיו, בואו נפתור את המשוואה שלנו:
- ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295))
- ln (1/P2) = (4889, 34) (-0, 00084)
- (1/P2) = ה(-4, 107)
- 1/P2 = 0.0165
-
P2 = 0.0165-1 = 60, 76 אטם.
זה הגיוני - בכלי סגור העלאת הטמפרטורה לכמעט 100 מעלות (לכמעט 20 מעלות מעל נקודת הרתיחה) תייצר הרבה אדים ותגדיל את הלחץ במהירות.
שיטה 2 מתוך 3: מציאת לחץ אדי עם פתרון מומס
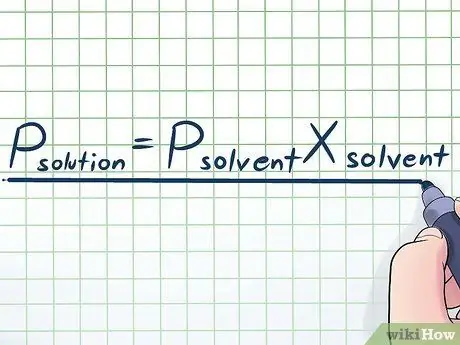
שלב 1. רשום את חוק ראולט
בחיים האמיתיים אנו עובדים לעתים רחוקות עם נוזל טהור - בדרך כלל אנו עובדים עם נוזל שהוא תערובת של כמה חומרים שונים. חלק מהתערובות הנפוצות ביותר מיוצרות על ידי המסת כמות קטנה של כימיקל מסוים הנקרא מומס בכימיקלים רבים הנקרא ממס ליצירת תמיסה. במקרים אלה כדאי להכיר משוואה הנקראת חוק ראולט (על שם הפיזיקאי פרנסואה-מארי ראולט), הכתובה כך: פמומס= פמֵמֵסאיקסמֵמֵס. בנוסחה זו, המשתנים מייצגים;
-
פמומס:
לחץ אדי של כל הפתרון (כל האלמנטים יחד)
-
פמֵמֵס:
לחץ אדי ממס
-
איקסמֵמֵס:
חלק שומה של ממס
- אל תדאג אם אינך מכיר מונחים כמו שומה שומה - נסביר אותם בשלבים הבאים.

שלב 2. קבע את הממס והמסיס בתמיסה שלך
לפני שתוכל לחשב את לחץ האדים של נוזל מעורב, עליך לזהות את החומרים שבהם אתה משתמש. כזכור, נוצר פתרון כאשר ממס מומס בממס - הכימיקל המתמוסס נקרא תמיד המומס, והכימיקל שגורם לו להתמוסס נקרא תמיד הממס.
- בואו נעבוד באמצעות הדוגמאות הפשוטות בחלק זה כדי להמחיש את המושגים בהם אנו דנים. לדוגמא שלנו, נניח שאנחנו רוצים למצוא את לחץ האדים של סירופ סוכר. באופן מסורתי, סירופ סוכר הוא סוכר מסיס במים (יחס 1: 1), כך שאנו יכולים לומר זאת סוכר הוא המסיס שלנו והמים הם הממס שלנו.
- שים לב שהנוסחה הכימית לסוכרוז (סוכר שולחני) היא C12ח22או11. נוסחה כימית זו תהיה חשובה מאוד.
שלב 3. מצא את הטמפרטורה של הפתרון
כפי שראינו בקטע קלאוסיוס קלאפיירון לעיל, הטמפרטורה של נוזל תשפיע על לחץ האדים שלו. באופן כללי, ככל שהטמפרטורה גבוהה יותר, לחץ האדים גדול יותר - ככל שהטמפרטורה עולה, יותר מהנוזלים יתאדו וייצרו אדים, ויגדילו את הלחץ במיכל.
בדוגמה שלנו, נניח שהטמפרטורה של סירופ הסוכר בשלב זה היא 298 ק (בערך 25 מעלות צלזיוס).
שלב 4. מצא את לחץ האדים של הממס
לחומרי התייחסות כימיים יש בדרך כלל ערכי לחץ אדים עבור חומרים ותרכובות נפוצים רבים, אך ערכי לחץ אלה תקפים בדרך כלל רק אם יש לחומר טמפרטורה של 25 C/298 K או נקודת הרתיחה שלו. אם לפתרון שלך יש אחת מהטמפרטורות הללו, תוכל להשתמש בערך ייחוס, אך אם לא, יהיה עליך למצוא את לחץ האדים בטמפרטורה זו.
- ה- Clausius -Clapeyron יכול לעזור - השתמש בלחץ אדי התייחסות ו- 298 K (25 C) עבור P1 ו- T1 בהתאמה.
- בדוגמה שלנו, לתערובת שלנו יש טמפרטורה של 25 מעלות צלזיוס, כך שנוכל להשתמש בקלות בטבלת ההתייחסות הקלה שלנו. אנו יודעים כי ב 25 מעלות צלזיוס, למים יש לחץ אדי של 23.8 מ"מ HG

שלב 5. מצא את חלק השומה של הממס שלך
הדבר האחרון שעלינו לעשות לפני שנוכל לפתור זאת הוא למצוא את חלק השומה של הממס שלנו. למצוא את חלק השומה הוא קל: פשוט הפוך את התרכובות שלך לשומות, ואז מצא את האחוז של כל תרכובת במספר השומות הכולל בחומר. במילים אחרות, חלק השומה של כל תרכובת שווה ל- (שומות תרכובת)/(מספר השומות הכולל בחומר).
-
נניח שהמתכון שלנו לשימושי סירופ סוכר 1 ליטר (ליטר) מים וליטר סוכרוז (סוכר).
במקרה זה, עלינו למצוא את מספר השומות של כל תרכובת. לשם כך נמצא את המסה של כל תרכובת ולאחר מכן נשתמש במסה הטוחנת של החומר כדי להפוך אותה לשומות.
- מסה (1 ליטר מים): 1,000 גרם (גרם)
- מסה (1 ליטר סוכר גולמי): כ -1,056, 8 גרם
- שומות (מים): 1,000 גרם × 1 מול/18.015 גרם = 55.51 מול
- שומות (סוכרוז): 1,056, 7 גרם × 1 מול/342.2965 גרם = 3.08 שומות (שים לב שניתן למצוא את המסה הטוחנת של סוכרוז מהנוסחה הכימית שלה, C12ח22או11.)
- סה"כ שומות: 55.51 + 3.08 = 58.59 מול
- חלק שומה של מים: 55, 51/58, 59 = 0, 947
שלב 6. סיים
לבסוף, יש לנו כל מה שאנחנו צריכים כדי לפתור את משוואת חוק ראול שלנו. חלק זה קל מאוד: פשוט חבר את הערכים שלך למשתנים במשוואת חוק ראול הפשוט בתחילת סעיף זה (פמומס = פמֵמֵסאיקסמֵמֵס).
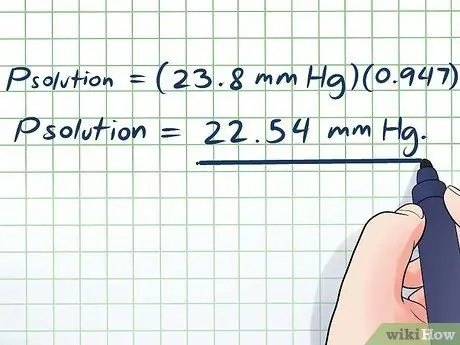
- תוך הזנת הערכים שלנו, אנו מקבלים:
- פפִּתָרוֹן = (23.8 מ"מ כספית) (0, 947)
-
פפִּתָרוֹן = 22.54 מ מ כספית.
התוצאה הגיונית - במונחים של שומה, מעט מאוד סוכר מומס בהרבה מים (אם כי במונחים אמיתיים, לשני המרכיבים יש אותו נפח), כך שלחץ האדים יורד רק במעט.
שיטה 3 מתוך 3: איתור לחץ אדים במקרים מיוחדים

שלב 1. היזהר בתנאי טמפרטורה ולחץ סטנדרטיים
מדענים משתמשים לעתים במערכת ערכי טמפרטורה ולחץ כ"סטנדרט "קל לשימוש. ערכים אלה נקראים טמפרטורה ולחץ סטנדרטיים (או STP). בעיות לחץ אדים מתייחסות לרוב לתנאי STP, ולכן חשוב לזכור ערכים אלה. ערכי STP מוגדרים כ:
- טֶמפֶּרָטוּרָה: 273, 15 ק / 0 ג / 32 פ
- לַחַץ: 760 מ"מ כספית / 1 אטם / 101, 325 קילופאקל

שלב 2. סדר מחדש את משוואת קלאוסיוס-קלאפיירון כדי למצוא את המשתנים האחרים
בדוגמה שלנו בחלק 1, ראינו שמשוואת קלאוסיוס -קלאפיירון שימושית מאוד למציאת לחץ האדים של חומרים טהורים. עם זאת, לא כל השאלות יבקשו ממך לחפש P1 או P2 - רבות יבקשו ממך למצוא את ערך הטמפרטורה או לפעמים אפילו את ערך H.קִיטוֹר. למרבה המזל, במקרים אלה, קבלת התשובה הנכונה היא פשוט סידור מחדש של המשוואה כך שהמשתנים שברצונך לפתור נפרדים בצד אחד של סימן השווים.
- לדוגמה, נניח שיש לנו נוזל לא ידוע עם לחץ אדים של 25 טור ב 273 K ו 150 טור ב 325 K, ואנו רוצים למצוא את אנתלפיה של אידוי הנוזל הזה (ΔHקִיטוֹר). אנחנו יכולים לפתור את זה כך:
- ln (P1/P2) = (ΔHקִיטוֹר/R) ((1/T2) - (1/T1))
- (ln (P1/P2))/((1/T2) - (1/T1)) = (ΔHקִיטוֹר/R)
- R × (ln (P1/P2))/((1/T2) - (1/T1)) = Hקִיטוֹר כעת, אנו מזינים את הערכים שלנו:
- 8, 314 J/(K × Mol) × (-1, 79)/(-0, 00059) = Hקִיטוֹר
- 8, 314 J/(K × Mol) × 3,033, 90 = Hקִיטוֹר = 25,223, 83 J/mol

שלב 3. חישוב לחץ האדים של המומס כאשר החומר מייצר אדים
בדוגמה שלנו בחוק Raoult לעיל, המסיס שלנו, הסוכר, אינו מפעיל לחץ בכוחות עצמו בטמפרטורות רגילות (חשבו - מתי בפעם האחרונה ראיתם קערת סוכר מתאדה בארון העליון שלכם?) אולם כאשר המומס שלכם עשה זאת להתאדות, זה ישפיע על לחץ האדים שלך. אנו מתייחסים לכך באמצעות גרסה שונה של משוואת חוק ראול: פפִּתָרוֹן = (עמ 'מתחםאיקסמתחם) הסמל סיגמא (Σ) פירושו שעלינו להוסיף רק את כל לחצי האדים של התרכובות השונות כדי לקבל את תשובתנו.
- לדוגמה, נניח שיש לנו פתרון המורכב משני כימיקלים: בנזן וטולואן. הנפח הכולל של הפתרון הוא 12 מיליליטר (מ"ל); 60 מ"ל בנזן ו -60 מ"ל טולואן. טמפרטורת הפתרון היא 25 מעלות צלזיוס ולחצי האדים של כל אחד מהכימיקלים הללו בטמפרטורה של 25 מעלות צלזיוס הם 95.1 מ"מ כספית לבנזן ו -28.4 מ"מ כספית לטולואן. עם ערכים אלה, מצא את לחץ האדים של הפתרון. אנו יכולים לעשות זאת כדלקמן, תוך שימוש בצפיפות סטנדרטית, מסה טוחנת וערכי לחץ אדים לשני הכימיקלים שלנו:
- מסה (בנזן): 60 מ"ל = 0.060 ליטר ופעמים 876.50 ק"ג/1,000 ליטר = 0.053 ק"ג = 53 גרם
- מסה (טולואן): 0.060 ליטר & פעמים 866, 90 ק"ג/1,000 ליטר = 0.052 ק"ג = 52 גרם
- מול (בנזן): 53 גרם × 1 מול/78, 11 גרם = 0.679 מול
- שומות (טולואן): 52 גרם × 1 מול/92, 14 גרם = 0.564 מול
- סה"כ שומות: 0.679 + 0.564 = 1.243
- חלק שומה (בנזן): 0.679/1, 243 = 0.546
- חלק שומה (טולואן): 0.564/1, 243 = 0.454
- פתרון: פפִּתָרוֹן = פבֶּנזִיןאיקסבֶּנזִין + פטולואןאיקסטולואן
- פפִּתָרוֹן = (95.1 מ"מ כספית) (0, 546) + (28.4 מ"מ כספית) (0, 454)
- פפִּתָרוֹן = 51.92 מ"מ כספית + 12.89 מ"מ כספית = 64, 81 מ"מ כספית
טיפים
- כדי להשתמש במשוואת קלאוסיוס קלאפיירון למעלה, יש למדוד את הטמפרטורה בקלווין (כתוב כ- K). אם יש לך את הטמפרטורה בצלזיוס, עליך להמיר אותה באמצעות הנוסחה הבאה: טק = 273 + Tג
- ניתן להשתמש בשיטות לעיל מכיוון שהאנרגיה פרופורציונלית בדיוק לכמות החום המופעלת. טמפרטורת הנוזל היא הגורם הסביבתי היחיד המשפיע על לחץ האדים.






