- מְחַבֵּר Jason Gerald [email protected].
- Public 2023-12-16 11:12.
- שונה לאחרונה 2025-01-23 12:18.
דילול הוא תהליך של הפיכת פתרון מרוכז לדליל יותר. ישנן מגוון סיבות לכך שמישהו ירצה לבצע דילול, החל מסיבות רציניות ועד פשוטות. לדוגמה, ביוכימאים מדללים תמיסות מצורותיהם המרוכזות כדי ליצור פתרונות חדשים לשימוש בניסויים, ואילו, לעומת זאת, ברמנים מרבים לדלל משקאות קלים או מיצים כדי שהקוקטיילים יהיו טעימים יותר. הנוסחה הכללית לחישוב דילול היא ג1ו1 = ג2ו2, עם ג1 ו- C.2 מייצג את הריכוזים הראשוניים והאחרונים של הפתרון, בהתאמה, ו- V1 ו- V.2 מייצג את עוצמת הקול.
שלב
שיטה 1 מתוך 2: ריכוזי דילול מדויקים באמצעות משוואת הדילול

שלב 1. קבע מה אתה יודע ומה אתה לא יודע
דילול בכימיה פירושו בדרך כלל לקיחת כמות קטנה של תמיסה ממנה אתה יודע את הריכוז, ולאחר מכן הוספת נוזל ניטרלי (כגון מים) ליצירת פתרון חדש בעל נפח גדול יותר אך ריכוז נמוך יותר. זה נעשה לעתים קרובות מאוד במעבדות כימיה, מכיוון שלמען האפקטיביות, ריאגנטים נשמרים לעתים קרובות בריכוזים גבוהים מאוד, אשר לאחר מכן מדוללים לשימוש בניסויים. בדרך כלל, ברוב המצבים בעולם האמיתי, תדע את ריכוז הפתרון הראשוני שלך ואת הריכוז או הנפח שאתה רוצה שהריכוז הסופי שלך יהיה, אך לא את נפח הפתרון הראשוני שאתה צריך כדי להשיג את הפתרון הסופי.
- עם זאת, במצבים אחרים (במיוחד בבעיות בית הספר), ייתכן שיהיה עליך למצוא חלקים אחרים של הפאזל - לדוגמה, ייתכן שתקבל נפח וריכוז ראשוניים, ולאחר מכן תתבקש למצוא את הריכוז הסופי אם תדלל פתרון. לנפח הרצוי. בכל מקרה של דילול, כדאי לשים לב למשתנים הידועים והלא ידועים לפני שמתחילים.
-
בואו נסיים את שאלות הדוגמא. נניח שנתבקש לדלל תמיסה של 5 מ 'במים ליצירת 1 ליטר של תמיסה 1. מ מ. במקרה זה, אנו יודעים את ריכוז הפתרון ההתחלתי שלנו ואת הנפח והריכוז הסופי שאנו רוצים, אך לא את כמות הפתרון הראשוני שעלינו להוסיף עם מים כדי להשיג את התוצאה הרצויה.
תזכורת: בכימיה, M היא מדידת ריכוז הנקראת מולריות, המציין את השומות של חומר לליטר
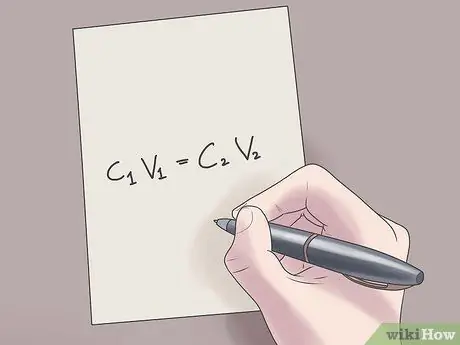
שלב 2. חבר את הערכים שלך לנוסחה C1ו1 = ג2ו2.
בנוסחה זו, ג1 הוא הריכוז הראשוני של הפתרון, V1 הוא נפח הפתרון הראשוני, ג2 הוא הריכוז הסופי של הפתרון, ו- V2 הוא נפח הפתרון הסופי. חיבור ערכים ידועים למשוואה זו יעזור לך למצוא ערכים לא ידועים בפחות קושי.
- ייתכן שתעזור לך לשים סימן שאלה מול היחידה שאתה רוצה לחפש כדי לעזור לך לפתור אותה.
-
בואו נמשיך את הדוגמא שלנו. נזין את הערכים שאנו מכירים כדלקמן:
- ג1ו1 = ג2ו2
- (5 מ ') ו1 = (1 מ"מ) (1 ליטר). לשני הריכוזים שלנו יש יחידות שונות. בואו נעצור כאן ונעבור לשלב הבא.

שלב 3. שקול את כל הבדלי היחידה
מכיוון שפתרונות כוללים שינויים בריכוז (שלפעמים יכולים להיות גדולים למדי), אין זה יוצא דופן שלשני המשתנים במשוואה שלך יש יחידות שונות. למרות שקל להתעלם מכך, יחידות לא שוות במשוואה שלך יכולות לגרום לתשובתך להיות שגויה. לפני סיום, המר את כל הערכים עם יחידות ריכוז ו/או נפח שונות.
-
בדוגמה שלנו, אנו משתמשים ביחידות שונות לריכוזים של M (טוחנות) ו- mM (מילימולרים). בואו נשנה את המדידה השנייה שלנו ל- M:
- 1 מ"מ × 1 מ '/1,000 מ"מ
- = 0.001 מ '

שלב 4. סיים
ברגע שכל היחידות שוות, פתור את המשוואה שלך. כמעט תמיד ניתן לעשות זאת בעזרת אלגברה פשוטה.
-
אנו עוצרים את בעיית הדוגמה שלנו כאן: (5 M) V1 = (1 מ מ) (1 ליטר). בואו למצוא את הערך של V1 עם היחידה החדשה שלנו.
- (5 מ ') ו1 = (0.001 מ ') (1 ליטר)
- ו1 = (0.001 מ ') (1 ליטר)/(5 מ').
-
ו1 = 0.0002 ליטר, או 0.2 מ ל.

שלב 5. להבין כיצד להשתמש בתשובה שלך בצורה נכונה
נניח שמצאת את הערך החסר שלך, אך אינך בטוח כיצד להשתמש במידע החדש הזה בדילול בפועל שאתה צריך לעשות. זה מובן - שפת המתמטיקה והמדע לפעמים לא תואמת את העולם האמיתי. כשאתה יודע את ארבעת הערכים במשוואה C1ו1 = ג2ו2, בצע את הדילול כדלקמן:
- מדוד את עוצמת הקול V1 מתמיסה בריכוז C1. לאחר מכן, הוסף דילולנט מספיק (מים וכו ') כדי להפוך את הנפח הכולל V2. לפתרון החדש הזה יהיה הריכוז שאתה רוצה (ג2).
- בדוגמה שלנו, למשל, אנו מודדים תחילה 0.2 מ"ל של פתרון 5 מ '. לאחר מכן נוסיף מספיק מים כדי להגדיל את נפח הפתרון ל -1 ליטר: 1 ליטר - 0.0002 ליטר = 0.9998 ליטר, או 999, 8 מ"ל. במילים אחרות, נוסיף 999.8 מ"ל מים לתמיסת הדגימה הקטנה שלנו. הפתרון החדש והמדולל שלנו כולל ריכוז של 1 מ"מ, שהוא הריכוז הרצוי שלנו.
שיטה 2 מתוך 2: הכנת פתרון דילול פשוט ומעשי

שלב 1. קרא כל אריזות למידע
ישנן מגוון סיבות לכך שאולי תרצה להכין פתרון לדילול בבית, במטבח או במעבדה לא כימית אחרת. למשל הכנת מיץ תפוזים מתרכיז פשוט היא דילול. במקרים רבים המוצר שצריך לדלל מכיל מידע על הדילול שצריך לבצע, אי שם על האריזה. יכול להיות שיש להם הוראות מדויקות לעקוב אחריהן. להלן מספר דברים שכדאי לחפש כאשר מחפשים מידע:
- נפח המוצר בשימוש
- נפח המדל בשימוש
- סוג המדל בשימוש (בדרך כלל מים)
- הוראות ערבוב מיוחדות
- ייתכן שלא תראה מידע על הריכוז המדויק של הנוזל המשמש. מידע זה אינו שימושי לצרכן הממוצע.

שלב 2. הוסף את החומר הפועל כמדלל לתמיסה המרוכזת
עבור דילולים ביתיים פשוטים, כמו אלה שאתה עשוי לבצע במטבח, אתה רק צריך לדעת את נפח התרכיז שבו אתה משתמש ואת הריכוז הסופי המשוער שאתה רוצה לפני שתתחיל. יש לדלל את התרכיז בכמות מתאימה של דילואנט, הנקבעת בהתאם לנפח הרכז ההתחלתי המשמש. ראה למטה:
- לדוגמה, אם נרצה לדלל 1 כוס רכז מיץ תפוזים ל -1/4 מהריכוז ההתחלתי שלו, נוסיף 3 כוסות מים לתוך התרכיז. לתערובת הסופית שלנו תהיה 1 כוס תרכיז ב -4 כוסות נוזל שלם - 1/4 מהריכוז ההתחלתי שלה.
- להלן דוגמה מסובכת יותר: אם רצינו לדלל 2/3 כוס תרכיז ל -1/4 מהריכוז ההתחלתי שלו, נוסיף 2 כוסות מים, כי 2/3 כוס שווה ל -1/2 כוס 2/3 כוס מהכמות נוזל שלם.
- הקפד להוסיף את החומר שלך במיכל גדול מספיק בכדי להכיל את הנפח הסופי שאתה רוצה - קערה גדולה או מיכל דומה.

שלב 3. התעלם מנפח האבקה ברוב המקרים
הוספת אבקה (כגון תערובות משקה מסוימות) לנוזל בדרך כלל אינה נחשבת לדילול. שינוי הנפח הנובע מתוספת כמות קטנה של אבקה לנוזל בדרך כלל קטן מספיק כדי להיות זניח. במילים אחרות, כאשר מוסיפים כמות קטנה של אבקה לנוזל, פשוט מוסיפים את האבקה לנפח הנוזל הסופי הרצוי ומערבבים.
אַזהָרָה
- עקוב אחר כללי הבטיחות המסופקים על ידי היצרן או הנדרשים על ידי החברה שלך. זה חשוב במיוחד אם אתה צריך לדלל את תמיסת החומצה.
- עבודה עם פתרונות חומציים עשויה לדרוש אמצעי בטיחות והנחיות מפורטים יותר מאשר עם פתרונות לא חומציים.






